Transgene Tiere
(Der Text der folgenden Seite stammt aus: "Transgene Mäuse - was, wozu, wie weiter?" Unipress 88, April 1996, von Anne-Catherine Andres, Abteilung für klinisch-experimentelle Forschung, Departement Klinische Forschung der Medizinischen Fakultät, Universität Bern)
Der Wunsch, Lebewesen nach eigener Vorstellung zu verändern, hat seit jeher das menschliche Denken beschäftigt. Mit den wegweisenden Experimenten von Gregor Mendel um 1865, welche erstmals die Vererbbarkeit von Eigenschaften wissenschaftlich belegte, wurde es möglich, durch Kreuzung spezifische Merkmale einer Gattung zu selektionieren und durch Weiterzucht in reiner Form weiterzuerhalten. Mit der Entdeckung, dass die Deoxyribonukleinsäure (DNS) der Träger der gesamten genetischen Information ist und Gene definierte Abschnitte darin darstellen, eröffnete sich die Möglichkeit, spezifische Gene zu isolieren, zu manipulieren und wieder in einen Organismus einzuführen: die transgene Technologie ist möglich geworden. Transgen - ein Wort, das man in der letzten Zeit viel hört und das jeweils etwas gemischte Gefühle hinterlässt. Neben Mäusen, Schweinen, Kühen und Schafen haben in der letzten Zeit vorallem die transgenen Pflanzen Schlagzeilen gemacht. Am Beispiel der Mäuse soll dieser Beitrag die Hintergründe, Anwendungen, Nutzen und Einschränkungen der transgenen Technologie aufzeigen und dadurch die damit verbundene Mystik etwas ausleuchten.
Was und wie?
Transgene Organismen sind Lebewesen, welche ein experimentell eingeführtes (Fremd-)Gen stabil in ihrem Erbgut (Genom) integriert haben, als eigen anerkennen und nach den mendelschen Gesetzen weitervererben. Voraussetzung für die transgene Technologie ist die Tatsache, dass das Genom an und für sich keine starre Einheit ist, sondern natürlicherweise grosse Flexibilität besitzt. Nur ein kleiner Teil der DNS beinhaltet Gene, d.h. kodiert für Proteine. Der weitaus grössere Anteil ist nicht-kodierend (funktionslos?) und Veränderungen in diesem Bereich bleiben meist ohne Folgen; ein gewisser Schutz für die genetische Stabilität eines Organismus. So können fremde DNS-Stücke in das eigene Genom integriert werden, ohne dass zwangsläufig ein Effekt oder Schaden auftritt. Natürlicherweise haben sich gewisse Viren (z.B. AIDS) diese Eigenschaft zu Nutze gemacht, welche ihre genetische Information in die Wirt-DNS integrieren und so über lange Zeit latent vorhanden sein können, ohne die Funktion des Wirts zu beeinträchtigen. Experimentell ist diese Tatsache die Voraussetzung zur Gentechnologie.
Schematische Darstellung der Methodik zur Etablierung transgener Mäuse
In der Abb. unten ist der Vorgang zur Etablierung transgener Mäuse schematisch dargestellt:
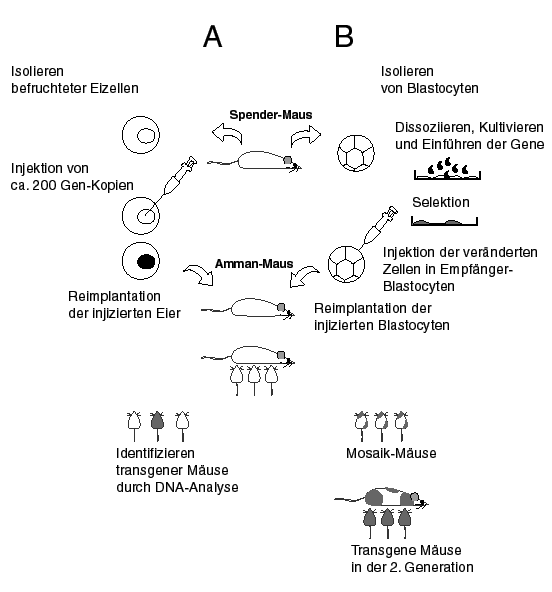
Zwei grundsätzliche Ansätze werden dazu angewendet: Die Injektion von DNS in befruchtete Eizellen (A) oder das Einbringen genetischen Materials in embryonale Stammzellen, die aus einem Embryo im 16 - 64 Zell-Stadium vor der Einnistung in den Uterus (Blastocysten) gewonnen wurden (B). Die Injektion befruchteter Eizellen (A) stellt die Originalmethode dar. Dazu werden einer Maus ca. 12 Stunden nach der Befruchtung die Eier aus dem Eileiter entnommem. In diesem Stadium haben sich der mütterliche und väterliche Zellkern noch nicht vereinigt und die erste Zellteilung hat noch nicht stattgefunden. Unter dem Mikroskop wird nun die DNS direkt in einen der beiden Kerne injiziert. Während der Verschmelzung der beiden Kerne wird das fremde genetische Material inkorporiert und schon in der ersten Zellteilung wie das eigene Material an die zwei Tochterzellen verteilt. Die manipulierten Eier werden nun in den Eileiter von pseudoschwangeren Ammenmütter zurückgeführt, wo sie sich entwickeln und die Mäuse nach 3 Wochen zur Welt kommen. Da die Fremd-DNS vor der ersten Zellteilung ins Genom integriert wurde, ist sie im fertig entwickelten Organismus in jeder Zelle des Körpers vorhanden. Unter den neugeborenen Tiere werden die transgenen Mäuse durch Analyse der DNA, meist aus einem Stückchen Schwanz oder einem Tropfen Blut gewonnen, identifiziert. Die erfolgreiche Integration der eingeführten DNA findet mit einer 10-30%igen Häufigkeit statt, d.h. lediglich 1/3 bis 1/10 der neugeborenen Mäuse ist auch tatsächlich transgen. Eine Weiterentwicklung dieser klassischen Methode verwendet embryonale Stammzellen als Empfänger der DNA (B). Diese Zellen sind noch nicht determiniert und unter geeigneten Kulturbedingungen unsterblich. Der Gentransfer findet hier in der Zellkultur statt und umfasst eine beliebige Anzahl von Zellen. Dieser Ansatz bietet den Vorteil, dass die gewünschten transgenen Zellen vor der Reimplantation in Kultur selektioniert werden können. Diese selektionierten Zellen werden nun in Empfängerembryos, ebenfalls im Blastocysten Stadium, injiziert, welche in Ammenmütter zurückgebracht werden. Während der Entwicklung werden die manipulierten Zellen in den Embryo inkorporiert und beteiligen sich am Aufbau des Organismus. Die neugeborenen Mäuse stellen somit ein Mosaik von eigenen und transgenen Zellen dar. Haben sich die transgenen Zellen am Aufbau der Keimzellen beteiligt, so werden diese die genetische Information der nächsten Generation beinhalten, mit anderen Worten, erst die zweite Generation wird tatsächlich transgen sein. Dies geschieht in ungefähr 25% der Tiere und somit hat dieser Ansatz eine ähnliche Erfolgsquote wie die klassische Methode.
Nicht nur methodisch, sondern auch konzeptuell lassen sich zwei grundsätzliche Strategien unterscheiden. Einerseits kann man ein definiertes, funktionelles Gen in das Genom einschleusen und somit eine zusätzliche Funktion oder einen Funktionsgewinn erreichen. Durch die vorhergehende in vitro Rekombination mit geeigneten Schaltelementen kann man erreichen, dass, obwohl jede Zelle des Körpers das fremde Gen trägt, dieses Gen jedoch nur in ganz spezifischen Zelltypen, z.B. Blutzellen, Hirnzellen oder Brustzellen, aktiv ist. Das andere Konzept zielt gerade auf das Gegenteil, nämlich auf das Ausschalten spezifischer Gene oder auf den Verlust der Genfunktion. Das Etablieren solcher transgener Mäuse, auch "Knock-out" Mäuse genannt, ist technisch sehr aufwendig und bedingt die Verwendung embryonaler Stammzellen. Hier wird nämlich die Eigenschaft der DNS ausgenutzt, mit komplementären Sequenzen eine Basenpaarung einzugehen. In vitro wird nun die Struktur eines isolierten Gens punktuell verändert und dadurch seine Funktion verunmöglicht. Schleust man eine solche Sequenz in Zellen ein, so vermag sie den entsprechenden Lokus im Genom zu finden, sich anzulagern und bei der nächsten Zellteilung gegen die endogene Sequenz ausgetauscht zu werden. Ein solches Ereignis findet allerdings nur mit einer Häufigkeit von ca. 1:106 statt. Diese Zahl erklärt die Notwendigkeit, Zellen als Empfänger zu verwenden, welche in Kultur zu beliebiger Anzahl vervielfältigt werden können.
Wozu?
Höhere Lebewesen zeichnen sich dadurch aus, dass sie aus einer Vielzahl verschiedenster Zelltypen bestehen, alle mit einer definierten unterschiedlichen Funktion, welche miteinander interagieren, sich gegenseitig beeinflussen und kontrollieren. Will man die molekularen Hintergründe der Funktion eines Organismus und deren Versagen in pathologischen Vorgängen Verstehen, so ist man letztendlich immer darauf angewiesen, eine Fragestellung im Kontext des gesamten Lebewesens anzugehen. Die transgene Technologie bietet die Möglichkeit dazu und hat eine ganze Palette von neuen Aspekten in den Bereich der Grundlagenforschung, der Medizin und der Pharmakologie gebracht.
Im Bereich der Grundlagenforschung sind die transgenen Mäuse ein ideales Modellsystem, um die Regulation und Funktion von einzelnen Genen zu untersuchen. Dabei spielen vor allem entwicklungsbiologische Fragestellungen, die in Zellkultursystemen nicht angegangen werden können, eine vorherrschende Rolle. Besonders sei hier erwähnt, dass die transgenen Mäuse ein grundlegender Durchbruch zum Verständnis der Funktion des Immunsystems waren. Anhand dieser Technologie konnten fundamentale Erkenntnisse üden Aufbau der zellulären und humoralen Immunantwort gewonnen werden. Ebenso waren transgene Mäuse massgebend zur Aufklärung, wieso das Immunsystem "selbst" von "fremd" zu unterscheiden vermag; eine Voraussetzung zum Verständnis der Autoimmunkrankheiten.
Die transgene Maus als Krankheitsmodell:
Das wichtigste Einsatzgebiet der transgenen Mäuse ist wohl im Bereich der Medizin, nämlich das Erstellen eines Tiermodells für spezifische menschliche Krankheitsbilder. Die transgenen Tiermodelle bieten den Vorteil, dass sich das induzierte Krankheitsbild weitervererbt und sich dadurch nicht nur in einem Individuum in verschiedensten Altersstufen, sondern auch über Generationen in beliebig vielen verschiedenen Individuen verfolgen lässt. In der Abb. unten sind die wichtigsten Krankheiten zusammengestellt, für die heute transgene Maus-Modelle bestehen:
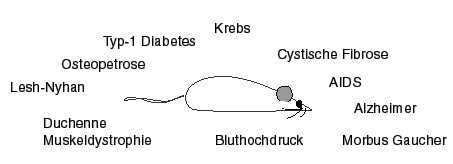
Dabei stehen zwei Forschungsrichtungen im Vordergrund:
- Durch die gezielte Ueberfunktion spezifischer Gene können Krankheitsbilder induziert werden, welche menschlichen Krankheiten sehr ähnlich sind. In diese Rubrik gehören die Modelle für Bluthochdruck (Angiotensin-, Renin-Gene), diverse Krebsarten (Onkogene), AIDS (HIV-Genom oder Teile davon), Alzheimer Krankheit (Amyloid-Gen), Osteopetrose (c-fos Gen), Typ-1 Diabetes (Influenza-Haemagglutinin-Gen). An Hand solcher Modelle lässt sich der Krankheitsverlauf studieren um neue gezielte Behandlungsstrategien zu überprüfen. Da es sich um einen intakten Organismus handelt, bietet das transgene Modelsystem den Vorteil, dass therapeutische Ansätze nicht nur auf ihre Wirksamkeit gegen die pathologische Funktion, sondern auch bezüglich ihrer Nebenwirkungen analysiert werden können.
- Die "Knock-out" Mäuse ermöglichen es, normale gegen defekte Gene auszutauschen und somit Modelle für jede Krankheit herzustellen, die auf der Mutation eines einzigen Gens beruhen. Man verfügt heute über Modelle für Duchenne Muskeldystrophie (Mutation des Dystrophin-Gens auf X-Chromosom), cystische Fibrose (Mutation in einem Gen auf Chromosom 7, welches für einen epithelialen Cl- Kanal kodiert), Morbus Gaucher (Mutation des Glucocerebrosidase-Gens) und Lesh-Nyhan Syndrom (Mutation des X-chromosomalen Hypoxanthin-Guanin-Phosphoribosyltransferase-Gens). Durch diese Modelle lässt sich der kausale Zusammenhang von Gendefekt und Krankheitsbild direkt nachweisen und wiederum können therapeutische Ansätze zur Behebung des Gendefektes untersucht werden.
Als dritten Anwendungsbereich der transgenen Technologie möchte ich die Produktion von pharmazeutischen Erzeugnissen und die Etablierung "verbesserter" landwirtschaftlicher Erzeugnisse zusammenfassen. Diese Bereiche verwenden nicht mehr Mäuse als Genträger, wohl aber dienten auch hier transgenen Mäuse als Prototyp zum Etablieren der Systeme.
Viele Krankheiten des Menschen lassen sich durch die Verabreichung eines spezifischen Proteins lindern. Das wohl weitverbreitetste Beispiel ist die Zuckerkrankheit, deren Effekte sich durch regelmässige Injektion von Insulin beheben lassen. Dies bedingt jedoch, dass genügend biologisch aktives Insulin isoliert werden kann. Die Reinigung solch biologisch aktiver Proteine aus natürlichen Quellen ist ein aufwendiges Verfahren mit niedriger Ausbeute und folglich hohen Kosten. Eine Alternative war deshalb, mit Hilfe der Gentechnologie solche Proteine bakteriell herstellen zu lassen. Dies garantiert eine hohe Produktion mit geringen Kosten. Es hat sich aber herausgestellt, dass einige Proteine einer komplexen Modifizierung bedürfen um biologisch aktiv zu sein, eine Modifizierung, wie sie nur von höheren Organismen ausgeführt wird. Eine neue Strategie besteht deshalb darin, transgene Schafe oder Kühe zu etablieren, welche das menschliche Gen für bestimmte Proteine in ihrem Genom tragen, dieses Gen nur in den Milchdrüsen exprimieren und das Produkt in die Milch sekretieren. Solche Tiere können täglich bis zu 5g/Liter des gewünschten Proteins produzieren und ein bis zwei solcher Tiere könnten den gesamten Weltbedarf einer spezifischen Substanz abdecken. Zur Zeit existieren Tiere zur Produktion von Antitrypsin (Blutgerinnungshemmer), Blutkoagulierungsfaktor VIII und XI (Haemophilie) und Glucocerebrosidase (Morbus Gaucher). Allerdings bietet die Aufreinigung der Proteine im grossen Massstab noch Schwierigkeiten, so dass vorerst nur kleine Mengen auf den Markt gelangen.
Die Anwendung der transgenen Technologie zur Verbesserung landwirtschaftlicher Erzeugnisse hat in der letzten Zeit viel Diskussionsstoff gebracht. Anstrengungen werden unternommen, um auf diesem Weg eine verbesserte Qualität der Kuhmilch zu erreichen oder aber die Wollqualität der Schafe zu verändern. Bereits in unseren Einkaufsläden erhältlich sind transgene Früchte und Gemüse, deren Genom neben einer angestrebten Verbesserung der Qualität vor allem in Richtung Krankheitsresistenz verändert wurde.
Die Konsumation gentechnologischer Erzeugnisse mag Bedenken und Schwellenängste auslösen. Ich denke aber, dass man sich durch die Terminologie nicht verunsichern lassen sollte. In diesem Bereich bietet die transgene Technologie lediglich die Möglichkeit, gezielt und in geringem Zeitraum zu erreichen, was seit jeher durch Kreuzen und Züchten angestrebt wurde. Die Gefahren dieser transgenen Tier- und Pflanzenarten sind deshalb vergleichbar mit denjenigen der konventionell etablierten spezialisierten Arten, nämlich die Reduktion der Artenvielfalt und -variabilität, welche doch eigentlich die natürliche Anpassung einer Gattung an sich verändernde Lebensbedingungen durch das Ueberleben einiger Individuen garantiert.
Wie weiter?
Zusammenfassend hat die transgene Technologie grundlegende Durchbrüche gebracht zur Aufklärung der molekularen Mechanismen zellulärer, physiologischer und pathologischer Vorgänge in einem Organismus. Auch bietet sie Modellsysteme zur Evaluation neuer Behandlungsstrategien in der Medizin und zur Herstellung physiologisch aktiver Proteine zu Therapiezwecken. Ganz sicher aber ist die transgene Technologie nicht unumstritten. Die ethische Frage, wie weit der Mensch zu seinem Nutzen in die Natur eingreifen darf, ist ein immer wiederkehrendes Thema in allen Forschungsbereichen und muss wohl von jedem für sich beantwortet werden. Konkret könnte aber die transgene Technologie die Grundlage und das Know-how zur Manipulation des menschlichen Genoms liefern, eine Vorstellung, die berechtigterweise Aengste auslöst. Von seiten des Gesetzgebers sind deshalb Manipulationen an menschlichen Embryos untersagt. Von der wissenschaftlichen Seite gilt es, folgenden Punkt zu bedenken: Obwohl vielversprechende Ansätze und Anwendungsmöglichkeiten vorhanden sind, ist die transgene Technologie kein Allerweltsmittel und unterliegt technischen Grenzen, für die keine Lösung absehbar ist. Vor allem die ungemein niedrigen Erfolgschancen eines Gentransfers verunmöglichen seine Anwendung zur Manipulation der menschlichen Keimbahn. Ob hingegen die Gentechnologie zur Korrektur gewisser körpereigener Zellen, z.B. Krebszellen, eingesetzt werden kann und soll, wird die Zukunft zeigen. Wie in anderen technologischen Anwendungen wissenschaftlicher Erkenntnis (Energie und Umwelt, Physik oder Intensivmedizin) ist auch die transgene Technologie an einem Punkt angelangt, wo Chancen und Risiken sorgfältig gegeneinander abgewogen werden müssen. Die Diskussion über Nutzen und Gefahr darf aber auch in diesem Gebiet nicht im wissenschaftlichen Vakuum stattfinden, sondern muss breit angelegt und von der gesamten Gesellschaft getragen werden.
Xenotransplantation
Unter Xenotransplantation versteht man die Verpflanzung von Organen zwischen unterschiedlichen Tierspezien, wie zum Beispiel zwischen Schwein und Mensch.