Medikamentenherstellung
Schon seit längerem benutzt man in der Pharmaindustrie Pilze zur Penizillinherstellung und Bakterien zur Produktion von Streptomycin (Antibiotikum). Durch die DNA-Klonierung wird es nun möglich, menschliche Proteine in Bakterien herzustellen.
Die Klonierung des Gens oder der cDNA ist der erste von vielen Schritten, um gentechnisch ein Protein für medizinische oder industrielle Anwendungen herzustellen. Der nächste Schritt besteht darin, das Gen in eine Wirtszelle einzuschleusen und es darin zu exprimieren. Die bekanntesten Expressionssysteme sind die Bakterien E.coli und Bacillus subtilis, die Hefe, sowie kultivierte Insekten- und Säugerzellen.
Weitere Infirmationen finden Sie im Kapitel ["DNA-Klonierung"] und im Video "DNA-Klonierung"
Vor- und Nachteile der verschiedenen Expressionssysteme
Bakterien:
- Bakterien sind einfache Systeme mit kurzen Generationszeiten, hoher Ausbeute und niedrigen Kosten.
Mögliche Probleme bei der Proteinherstellung in Prokaryoten:
- Einige Proteine werden zwar stark exprimiert, falten sich jedoch nicht korrekt und bilden unlösliche Einschlusskörper. Die extrahierten Proteine sind oft inaktiv.
- Fremdproteine sind für Bakterien manchmal toxisch, so dass diese Kulturen nicht in hoher Dichte wachsen.
- Den Bakterien fehlen die Enzyme, welche Proteine in eukaryotischen Zellen nach der Translation modifizieren (Anhängen von Phosphatgruppen oder Zuckerresten).
- Als Alternative wird die Hefe verwendet, ein einfacher Eukaryont, der in vielem den Säugerzellen ähnlich ist. Sie lässt sich aber so schnell und billig wie Bakterien vermehren und besitzt ebenfalls Plasmide. Im Unterschied zu den Bakterien führt die Hefe jedoch zahlreiche posttranslationelle Modifikationen durch. Ausserdem kann man die Sekretion bestimmter Proteine ins Nährmedium induzieren, was die Proteingewinnung erleichtert. Ein Nachteil ist, dass die Hefe sehr aktive Proteasen besitzt, welche Fremdproteine abbauen und somit die Produkteausbeute verringern. Diese Problem wurde umgangen, indem man Hefestämme mit Deletionen gewisser Protease-Gene konstruierte.
Weitere Infirmationen zu Hefe finden Sie im Atelier im Dokument "Hefen in der Gentechnik".
Säugerzellen:
- Eine weitere Möglichkeit zur Proteinproduktion ist die Verwendung von Säugerzellen. Die Kultivierung von Säugerzellen ist allerdings in der Regel schwieriger und teurer.
Beispiele gentechnisch hergestellter Medikamente:
- Insulin
- Blutgerinnungsfaktor-Faktor VIII
- Wachstumshormon
- Interferon
Beispiel Insulin
Bedeutung des Insulins
Insulin ist ein wichtiges, den Zuckerstoffwechsel regulierendes Hormon, das nur von wenigen Zellen in der Bauchspeicheldrüse (Pankreas) hergestellt und in den Blutkreislauf ausgeschüttet wird. Defekte in der Insulinproduktion führen zum Diabetes mellitus; tägliche, subcutane Injektionen des Hormons genügen jedoch, um die schädlichen Auswirkungen der Zuckerkrankheit zu vermindern.
Herstellung des Insulins
Bevor man das rekombinierte Molekül herstellen konnte, wurde Insulin aus dem Pankreas von Schweinen und Rindern gewonnen. Der Nachteil dieser Methode ist, dass das so gewonnene Insulin nicht genau die gleiche Aminosäuresequenz hat wie das humane Insulin und dadurch antigen wirken kann. Da das gentechnisch erzeugte menschliche Insulin mit dem natürlichen Protein identisch ist, sollte es nicht antigen wirken.
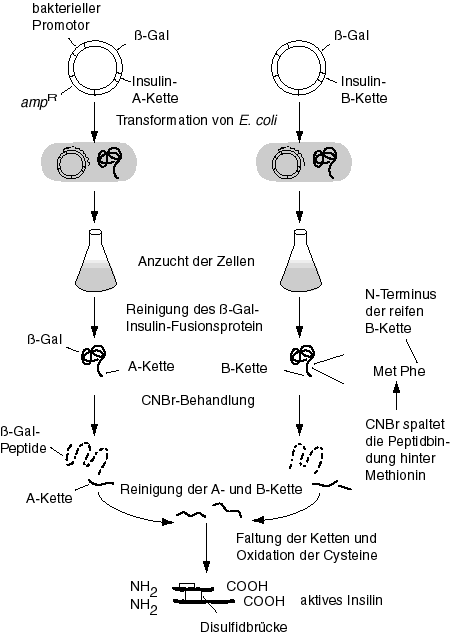
In Säugerzellen wird Insulin als Proprotein synthetisiert. Durch die Abspaltung der C-Kette entsteht das reife Insulin. Dieses besteht aus zwei Ketten, einer A- und einer B-Kette, welche durch Disulfidbrücken verknüpft sind. Das Protein wird nach der Translation nicht weiter modifiziert.
1978: Aus dem einen Gen für das Proinsulin wurden zwei Gene für die getrennte Synthese der A- und B-Ketten synthetisiert und in Plasmide eingebaut.Dort wurden sie unter der Kontrolle des Lac-Promotors transkribiert. Die gereinigten A- und B-Ketten wurden danach im Reagenzglas durch Disulfidbrücken verbunden. Dieser Vorgang war jedoch sehr ineffizient.
Heute wird das ganze Proinsulin synthetisiert. Dadurch kommt das Protein von selbst in die richtige räumliche Struktur. Die C-Kette wird im Nachhinein durch proteolytische Spaltung abgetrennt:
Beispiel Faktor VIII
Hämophilie und ihre Behandlung
Der Faktor VIII ist ein Protein, das für die normale Blutgerinnung benötigt wird. Genetisch bedingte Defekte der Faktor VIII-Synthese sind die Ursache für die Bluterkrankheit (Hämophilie).
Über viele Jahre behandelte man Bluter mit Faktor VIII-Präparaten, die aus menschlichem Blut gereinigt wurden. Dazu benötigte man viel Spenderblut und zudem bestand die Gefahr der Uebertragung von Infektionskrankheiten wie Hepatitis B oder AIDS.
Herstellung des Faktor VIII
Bei der Herstellung des Faktor VIII durch rekombinante DNA-Methoden besteht das Problem, dass es sich um ein grosses Gen mit 186 000 Basen (26 Exons und 25 Introns) handelt. Die cDNA umfasst noch 9 000 Basen. Zudem hat das fertige Protein 17 Disulfidbrücken und ist glykosyliert. Bakterien sind nicht in der Lage, Introns aus einem Gen zu schneiden und können auch keine posttranslationellen Modifikationen vornehmen. Aus diesen Gründen kann aktiver Faktor VIII nicht durch Bakterien produziert werden. Dieses Protein muss in Säugerzellen (Hamsterzellen) hergestellt werden. Zwar sind solche Kulturen anspruchsvoller, aber dafür stellen sie korrekt modifizierte, biologisch aktive Proteine her.
Impfstoffe
Herkömmliche Impfstoffherstellung
Zwei Typen von Impfstoffen waren in Gebrauch, bevor es die DNA- Rekombinationstechnik gab:
- Inaktivierte Impfstoffe: abgetötete Derivate des infektiösen Agens.
- Abgeschwächte (atenuierte) Impfstoffe: lebende Viren oder Bakterien, die so behandelt werden, dass sie sich im geimpften Organismus nicht mehr vermehren können.
Gentechnisch hergestellte Impfstoffe
Die Gentechnologie erlaubt die Herstellung von sogenannten Untereinheiten-Impfstoffen (subunit vaccines). Sie bestehen einzig aus dem Oberflächenprotein des Erregers, mit dem das Immunsystem reagiert. Diese Impfungen sind also nicht mit einem Infektionsrisiko verbunden.
Der erste erfolgreiche Untereinheiten-Impfstoff wurde gegen Hepatitis B-Virus (HBV) hergestellt. HBV befällt die Leber und kann zu Leberzyrrhose und Leberkrebs führen.
Zur Immunisierung wird das Oberflächenantigen HBsAg hergestellt, welches das Virus umhüllt. Man kloniert das HBV-Genom und isolierte das HBsAG. Da dieses in E.coli jedoch nicht produzierbar ist, wählte man Hefe als Proteinproduzent. Das HBsAG wird in einen Viel-Kopien-Expressionsvektor der Hefe eingesetzt und so verändert, dass es nicht mehr sezerniert wurde. Die damit transformierten Hefezellen bildeten grosse Mengen des viralen Proteins (1 - 2 % ihres Gesamtproteins).
Das rekombinierte Hefeprotein ist dem natürlichen Virusprotein sehr ähnlich und wird heute kommerziell zur Impfung gegen HBV-Infektionen eingesetzt.