Posttranslationale Modifikationen
Einige frisch hergestellte Proteine erhalten ihre endgültige biologisch aktive Konformation erst, nachdem sie durch eine oder mehrere Prozessierungsreaktionen, sogenannte posttranslationale Modifikationen, abgeändert worden sind. Folgende Angaben gelten sowohl für Prokaryoten wie für Eukaryoten (Ausnahme: Glycosylierung).
Amino-terminale und carboxy-terminale Modifikationen
Ursprünglich beginnen alle Polypeptide mit einem N-Formylmethionin- (bei Prokaryoten) oder Methionin-Rest (bei Eukaryoten). Diese und häufig noch weitere amino-terminale und carboxy-terminale Reste können jedoch enzymatisch entfernt werden und sind in den endgültigen funktionellen Proteinen nicht immer vorhanden.
Modifikation einzelner Aminosäuren
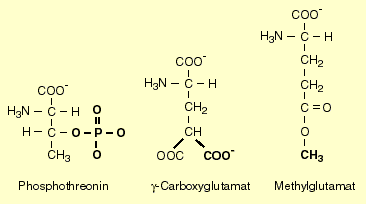
- Die Hydroxygruppe bestimmter Ser-, Thr- und Tyr-Reste einiger Proteine werden enzymatisch mittels ATP als Phosphatdonor phosphoryliert, wodurch die Polypeptide negative Ladungen erhalten.
- An die Asp- und Glu-Reste einiger Proteine können zusätzliche Carboxygruppen angefügt werden.
- In einigen Proteinen werden bestimmte Lys-Reste enzymatisch methyliert.
Glykosylierungen
Bei einigen Glykoproteinen wird während oder nach der Synthese der Polypeptidkette enzymatisch eine Kohlenhydrat-Seitenkette an Asparagin-Reste, bei andern an Serin- oder Threonin-Reste addiert. Viele extrazellulär lokalisierte Proteine sowie die die Schleimhäute auskleidenden Proteoglykane erhalten so ihre Oligosaccharid-Seitenketten.
Proteolytische Prozessierung
Viele Proteine, darunter das Insulin sowie die Proteasen Trypsin und Chymotrypsin, werden zunächst als grössere inaktive Vorstufen hergestellt, die dann proteolytisch zu ihrer endgültigen, aktiven Form gespalten werden.
Addition prosthetischer Gruppen
Viele prokaryotische und eukaryotische Proteine benötigen kovalent gebundene prosthetische Gruppen für ihre Funktion. Diese Gruppen werden an die Polypeptidkette angefügt, nachdem diese das Ribosom verlassen hat. Ein Beispiel hierfür ist die kovalent gebundene Hämgruppe des Cytochroms c.