Faltung und Struktur von Proteinen
Die Information für die richtige Faltungeines Proteins ist in der Aminosäure-Sequenz enthalten. Man kann sogar Eiweisse denaturieren und wieder renaturieren lassen. Das geht allerdings nicht bei allen Eiweissen bzw. nur unter ganz bestimmten Bedingungen. Ein Grund für diese Einschränkung liegt darin, dass die Faltung von Eiweissen in der Zelle fortlaufend mit der Eiweiss-Synthese und nicht erst nach abgeschlossener Synthese erfolgt. Neueste Forschungsergebnisse zeigen, dass sowohl prokaryotische wie eukaryotische Zellen über eine ganze Familie von Eiweiss-Enzymen verfügen, welche andere Eiweisse entfalten oder falten können. Diese Entfaltungs- oder Faltungsprozesse sind von der Hydrolyse von ATP durch diese Enzyme abhängig. Man weiss heute, dass diese katalysierten Entfaltungen bzw. Faltungen unter anderem beim Durchtritt von Eiweissen durch Membranen von grosser Bedeutung sind.
Man unterscheidet bei Proteinmolekülen vier Strukturebenen:
- Die Primärstruktur: die Abfolge der Aminosäuren:
- Die Sekundärstruktur ergibt sich aus regelmässigen Wasserstoffbrücken-Wechselwirkungen zwischen den Peptidbindungen selbst. Zwei Muster sind besonders häufig: die a-Helix und das b -Faltblatt.
- Die Tertiärstruktur ist die dreidimensionale Konformation eines Proteins: sie beschreibt die Lage aller Atome im Raum. Zusammengehalten wird die Tertiärstruktur durch eine Vielzahl von Wechselwirkungen zwischen verschiedenen Aminosäuren. Bei diesen Kräften handelt es sich um Wasserstoffbrückenbindungen, Ionenbindungen zwischen positiv und negativ geladenen Gruppen der Seitenketten, hydrophobe Bindungen im Innern der Proteine und Disulfidbrücken, die durch Dehydrierung (Oxidation) von zwei SH-Gruppen zweier Cystein-Reste entstehen:
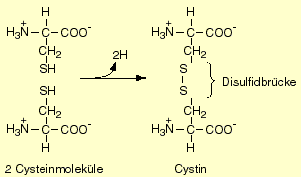
Im Peptidhormon Insulin werden zwei Aminosäure-Ketten unterschiedlicher Länge mittels Disulfidbrücken zusammengehalten. Die beiden Ketten sind Produkte einer einzigen Polypeptidkette. Im unreifen Proinsulin ist die A-Kette nämlich noch über ein C-Peptid (welches später entfernt wird) mit der B-Kette verbunden (Schema)XTertiärstruktur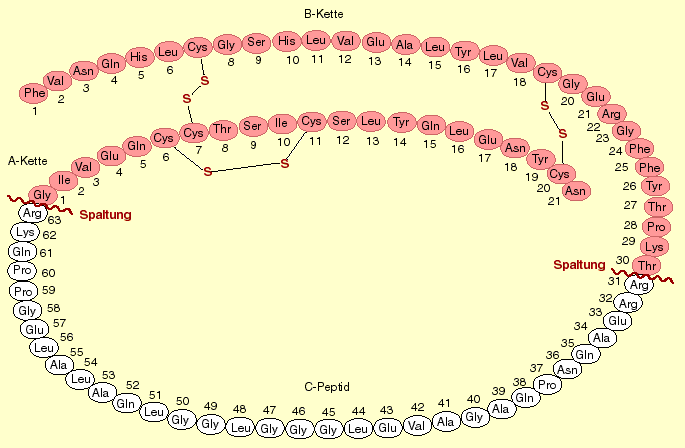
- Die Quartärstruktur: Von Quartärstruktur sprechen wir bei Proteinen, welche aus zwei oder mehr Untereinheiten bestehen. Es handelt sich bei der Quartärstruktur also um die räumliche Gestalt von Aggregaten von Polypeptidketten. Die Untereinheiten können identisch sein oder wie bei der RNA-Polymerase (a2bbg) unterschiedliche Aminosäuresequenzen beinhalten.
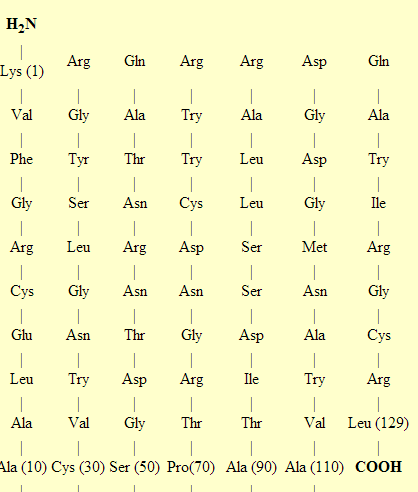

Primärstruktur von Lysozym aus Hühnereiweiss, das Bakterien angreift, indem es Murein abbaut.
Eine a-Helix entsteht, wenn sich eine Polypeptidkette regelmässig um sich selbst windet. Es entsteht ein "Zylinder", in dem jede Peptidbindung regelmässig mit weiteren Peptidbindungen über Wasserstoffbrücken verbunden ist. Die Seitenketten der Aminosäuren ragen dabei nach aussen.
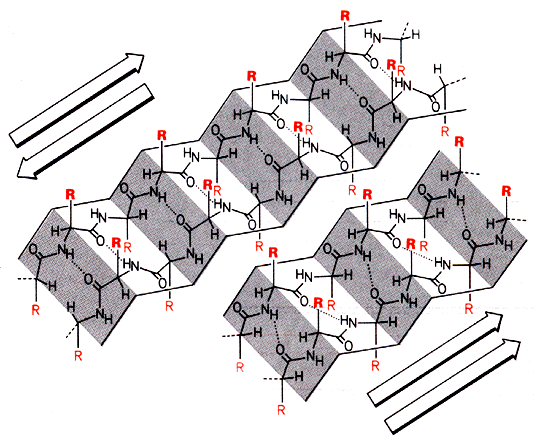
Das b -Faltblatt entsteht, wenn zwei Peptidketten nebeneinander zu liegen kommen und jede Peptidbindung mit seinem Gegenüber eine Wasserstoffbrücke ausbildet. Dieser Peptidrost ist ziehharmonika- ähnlich gefaltet, deshalb stehen die Seitenketten der Aminosäuren nahezu senkrecht nach oben oder nach unten. Faltblattstrukturen zwischen gegenläufigen, antiparallelen Ketten nennt man antiparallele b -Faltblätter, solche zwischen gleich-läufigen, parallelen Ketten parallele b -Faltblätter.
Schema
X
Sekundärstruktura-Helix
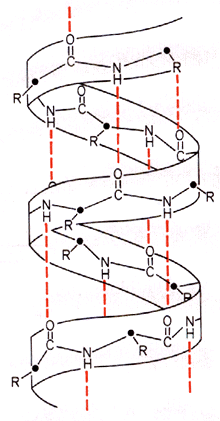
b-Faltblatt
Folgende Tabelle gibt eine Übersicht über einige Proteine mit Quartärstruktur:
| Protein | Molekulargewicht [Dalton] | Anzahl Untereinheiten |
| b-Lactoglobulin | 35'000 | 2 |
| Hämoglobin | 64'500 | 4 |
| Hexokinase | 96'000 | 4 |
| Lactat-Dehydrogenase | 150'000 | 4 |
| Apoferritin | 480'000 | 20 |
| Urease | 483'000 | 6 |
| Myosin | 620'000 | 3 |